Elektrochemie- Die Batterie
Gliederung
1. Der
Begriff der Batterie
2. Zu
klärende Begriffe
2.1
Galvanisierung
2.2
galvanische Zelle oder galvanisches Element
2.3
Kathode/ Anode
2.4
Donator/ Akzeptor
2.5
Diaphragma
3. Das
Prinzip einer Batterie
4. Spezielle
Batterien
4.1
LECLANCHÉ- Batterie oder Zink/ Kohle-Batterie
4.2
Alkali/ Mangan-Batterie
4.3
Knopfzellen oder Zink/ Luft-Batterie
4.4
Silberoxid- Batterie
4.5
Lithium- Batterie
4.6
Vergleich der einzelnen Typen
5.
Akkumulatoren
5.1
Das Prinzip eines Akkumulators
5.2
Blei- Akkumulator
5.3
Nickel/ Cadmium- Akkumulator und der Memory- Effekt
5.4
Nickel/ Metallhydrid- Akkumulator
6. Wissenswertes aus der Geschichte
1.
Batterien sind ortsunabhängige Spannungsquellen, bei denen die zum Betrieb von
Geräten
benötigte elektrische Energie auf elektrochemischem Wege erzeugt wird. Die
in
der Batterie stattfindenden Reaktionen sind Redoxreaktionen.
2. Eine Batterie ist ein spezielles galvanisches Element. Deshalb ist die
Begriffsklärung
an
dieser Stelle notwendig.
2.1
Das
Galvanisieren ist im einfachsten Sinne ein Verfahren, um auf elektrolytischem
Wege Gegen-
stände
mit einer Metallschicht zu überziehen. Möchte man z.B. ein Stück Eisenblech verkupfern,
hängt
man einfach in eine dissoziierte CuSO4 – Lösung (Elektrolyt)
ein Stück Kupfer- und ein Stück Eisenblech,
die
beide mit den Polen einer Gleichspannungsquelle verbunden sind.Diese Bleche
bezeichnet man hier
als
Elektroden. Durch das Anlegen einer Gleichspannungsquelle gibt die Kupferplatte
Elektronen
ab und die Eisenplatte nimmt sie auf. Sie ist nun negativ aufgeladen und zieht
die Kupfer-
ionen
aus der CuSO4 – Lösung an. Die beiden Elektronen beim Eisen gehen
nun zu den Kupferionen
und
bilden elementares Kupfer. Das Eisen hat sich mit einer Kupferschicht
überzogen(s.Abb.1).
Abb.1 Abb.2
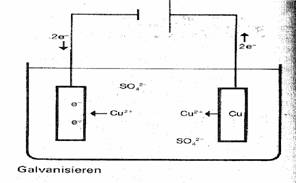
Bildung des elmentaren Kupfers: Cu2++2e-à Cu (Reduktion)
Abgeben der Elektronen: Cuà Cu2++2e- (Oxidation)
Auch die Reaktion des Galvanisierens ist eine
Redoxreaktion!
2.2 Man bezeichnet eine
galvanische Zelle als eine elektrochemische Zelle, in der freie chemische
Energie in elektrische umgewandelt werden kann.
Im einfachsten Fall sind hier zwei Metalle zu
einem geschlossenen Stromkreis miteinander verbunden.
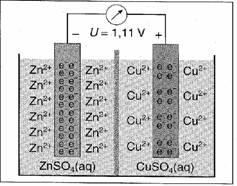
Am Beispiel der Kupfer/ Zink- Zelle lässt sich die
hier stattfindende Redoxreaktion gut erklären.
Die Zelle besteht aus zwei Elektroden, einer Zink-
und einer Kupferelektrode. Die Zelle wird durch das sogenannte Diaphragma in
zwei Halbzellen geteilt. In der Zinkhalbzelle befindet sich um die Zink-
elektrode herum Zinksulfatlösung und in der
Kupferhalbzelle um die Kupferelektrode Kupfersulfat-
lösung. Vom Minuspol, also von der Zinkelektrode,
fließen nun zur Kupferelektrode Elektronen. Das Zink wird hierbei ionisiert und
geht in die Zinksulfatlösung. Gleichzeitig nehmen die an der Kupfer-
elektrode angekommenen Elektronen Kupferionen aus
der Kupfersulfatlösung auf und bleiben in der
Elektrode; es bildet sich elementares Kupfer. Nun
ist folgendes passiert: durch diesen Elektronenfluss befinden sich in der
Zinksulfatlösung zu viele Zinkionen und in der Kupfersulfatlösung zu viele
Sulfat-
ionen, da die Kupferionen zur Zinkelektrode
gewandert sind. Die Reaktion in der Zelle kann aber nur
fortgesetzt werden, wenn ein Ladungsausgleich
zwischen den Elektrolytlösungen stattfindet. Dazu diffundieren nun die positiv
geladenen Zinkionen durch das Diaphragma zur Kupfersulfatlösung und die negativ
geladenen Sulfationen in die Zinksulfatlösung. Der Ladungsausgleich ist
hierdurch gegeben und ein geschlossener Stromkreis erreicht. Folgende
Reaktionen spielen hierbei eine wichtige Rolle(s.Abb.2).
Zn à Zn2+ + 2e- (Oxidation)
Cu2+ + 2e- à Cu (Reduktion)
Zn + Cu2+
à Cu + Zn2+(Redoxreaktion,
Zellreaktion)
2.3 Anode und Kathode sind die Elektroden eines
galvanischen Elementes. Vereinfacht kann man die Kathode als Minuspol und die
Anode als Pluspol eines galvanischen Elementes bezeichnen.
2.4 Als Donator bezeichnet man eine Substanz, die
Elektronen, Ionen, Atome und Protonen abgibt. Der Akzeptor ist dann
entsprechend die Substanz, die Elektronen, Ionen, Atome und Protonen aufnimmt.
Es müssen allerdings für eine solche Reaktion immer beide (Donator und
Akzeptor) vorhanden sein.
2.5 Das Diaphragma ist eine poröse Scheidewand, die
Kathoden- und Anodenraum einer Elektrolyse-
zelle voneinander trennt. Außerdem ermöglicht es
Landungsausgleiche durch Diffusion von Ionen.
3. Batterien erzeugen auf elektrochemischem Wege
elektrische Energie. Der Unterschied zum galvanischen Element ist aber, dass
Batterien hohe Spannungen erzeugen müssen, sonst wären sie kaum nutzbar. Man
benötigt also am Minuspol ein stark unedles Metall und am Pluspol ein starkes
Oxidations-
mittel. Außerdem sind auch die Größe der Elektrode
und die Art der Elektrolytlösung ausschlaggebend für die Kapazität und
Stromstärke der Batterie. Batterien funktionieren aber wie die galvanische
Zelle, deren Funktionsweise bereits erklärt worden ist. In Funktion und Bau
können sich Batterien jedoch unterscheiden.
4. Die wichtigsten Batterietypen werden in den
folgenden Punkten erklärt.
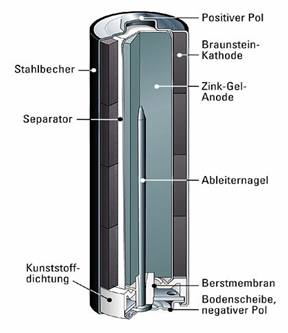
4.1 Diese vom Aufbau her recht einfache Batterie besteht
aus einem Zinkmantel, der den Minusopol darstellt und einem Kohlestift, der der
Pluspol ist. Dieser Stift besteht aus einem Gemisch von Graphit und Braunstein,
das wir als Mangan(IV)- oxid kennen und hier als Oxidationsmittel dient. Die
Elektrolytlösung ist hier Ammoniumchloridlösung.
Am Minuspol (Kathode) findet die Oxidation statt.
Hier wird das Zink oxidiert. Es gibt Elektronen ab und Zinkionen entstehen
(Reaktionsgleichung: Znà Zn2+ +2e-).
Die hier entstandenen Elektronen wandern zum Pluspol und reagieren mit dem Braunstein und den Hydroniumionen aus der Elektrolytlösung zu Mangan(III)- oxid. Die Oxidationszahl verringert sich;
eine Reduktion findet statt (Reaktionsgleichung: 2e-+2MnO2
+ 2H3O+ à Mn2O3 +
3H2O).
Die Hydroniumionen entstehen durch Protolyse der Ammoniumchloridlösung
(Reaktionsgleichung: NH4+ + H2O à NH3 + H3O+). Bei dieser Reaktion entsteht Ammoniak, der mit den oben entstandenen Zinkionen und den übrigen Chloridionen zu einem Komplexsalz reagiert. Es heißt Diamminzink(II)- chlorid. Das sieht dann so aus:
Zn2+ + 2NH3 + 2Cl- à
[Zn(NH3)2]Cl2 .
Diese Reaktionen laufen so lange ab, bis das Zink völlig in Ionen und Elektronen umgewandelt ist. Diese Batterie liefert eine Spannung von ungefähr 1,5V. Da der Zinkmantel an den elektrochemischen Reaktionen beteiligt ist, besteht Auslaufgefahr.
Hinweis: Zur Immobilisierung wird der Elektrolyt
mit z.B. Stärkekleister oder Gips verdickt.
Reaktionen im LECLANCHÉ- Element: Aufbau des LECLANCHÉ- Elementes:
Abb.3 Abb.4
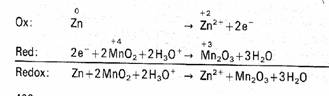

4.2 Eine Weiterentwicklung, aber auch eine Verbesserung, der LECLANCHÉ- Batterie stellt die Alkali/ Mangan- Batterie dar. Man könnte sie auch als eine Zink/ Kohle- Batterie bezeichnen. Sie ist aber anders konstruiert und hat Kaliumhydroxid als Elektrolyt. Außerdem reagiert hier nicht der Zinkbecher, sondern das Zinkpulver, das sich im Inneren der Batterie befindet. Die stahlummantelte Batterie ist also nahezu auslaufsicher. Die negative Zinkpulverelektrode veranlasst, dass auch hier das Zink oxidiert wird und Zinkionen sowie Elektronen entstehen. Pro Zeiteinheit kann hier mehr Zink oxidiert werden. Das ist ein Vorzug! An der positiven Elektrode befindet sich wiederum ein Graphit/ Braunstein- Gemisch. Das Zink reagiert mit den Hydroxidionen aus dem alkalischen Elektrolyten zu Zinkhydroxid und Elektronen. Das Braunstein reagiert mit Wasser und den oben entstandenen Elektronen zu Mangan(III)- oxid(Reduktion) und Hydroxidionen. Um den Stromkreis wiederum zu schließen, reagieren die überschüssigen Hydroxidionen mit dem Zinkhydroxid zu einem löslichen Hydroxozinkation
(Reaktionsgleichung: Zn(OH)2+OH-à[Zn(OH)4] 2-).
Dadurch bleibt die Konzentration an Zinkionen gering und es bilden sich keine Niederschläge. Zusammenfassend laufen also folgende Reaktionen ab:
Oxidation: Zn + 2 OH- à Zn(OH)2 + 2 e-
Reduktion: 2 MnO2 +
H2O + 2 e- à Mn2O3
+ 2 OH-
Redoxreaktion(vereinfacht): Zn0
+ 2 Mn+IV à Zn+II + 2 Mn+III.
Aufbau der Alkali/ Mangan- Batterie:
Abb.5
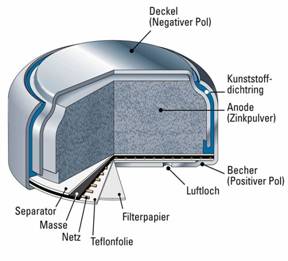
4.3 Anstelle des Braunsteins wird hier als Oxidationsmittel Luftsauerstoff benutzt. In dieser Batterie bildet Zink den Minuspol und ein Graphitstab den Pluspol. Als Elektrolyt dient wider Kaliumhydroxidlösung. Das besondere ist nun, dass dieser Graphitstab nur teilweise im Elektrolyten taucht und der andere Teil Kontakt zum Luftsauerstoff hat. Die Elektroden absorbieren den Sauerstoff jedoch. Daraus resultierend ergibt sich, dass die Elektroden katalytisch wirken und den Sauerstoff zu Hydroxidionen reduzieren. Das Zink wird gleichzeitig oxidiert. Die bei der Oxidation freiwerdenden Elektronen reagieren mit Luftsauer-
stoff und Wasser zu Hydroxidionen. Der Stromkreis wird dann durch eine weitere Reaktion geschlossen: Die Zinkionen reagieren dann mit den Hydroxidionen wieder zu Hydroxozinkationen
(Reaktionsgleichung: Zn(OH)2+OH-à[Zn(OH)4] 2-).
Auch hier findet wider eine Redoxreaktion statt, die sich wie folgt zusammensetzt:
2 Zn à 2 Zn2+ + 4e- (Oxidation)
O2
+ 2H2O + 4e- à 4 OH- (Reduktion)
2Zn + O2
+ 2H2O à 2Zn2+ + 4OH- (Redoxreaktion).
Hier kann eine Spannung von bis zu 1,34Volt erreicht werden. Man benutzt diese sogenannten Knopfzellen z.B. für Hörgeräte, Zäune oder Dauerbeleuchtungen.
Aufbau einer Zink/ Luft- Batterie:
Aufbau einer Silberoxid- Batterie:
Abb.6
Abb. 7
![]()
![]()
![]()
![]()
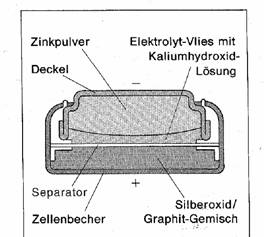
4.4 Um Batterien elektrisch besser nutzbar zu machen, erfand man eine Batterie in der Silberoxid (früher Quecksilberoxid) als Oxidationsmittel am Pluspol ist. Die notwendigen Elektronen liefert wieder Zink, der in Zinkionen und Elektronen zerfällt. Kaliumhydroxidlösung dient als Elektrolytlösung. Vorteilhaft ist hier, dass die Spannung beim Entladen nahezu konstant bleibt. In der Batterie laufen folg. Reaktionen ab:
Zn à Zn2+ + 2e- (Oxidation)
Ag2O + H2O + 2e- à
2Ag + 2 OH- (Reduktion)
Zn + Ag2O + H2O à
Zn2+ + 2Ag +2OH- (Redoxreaktion).
Die Wiederverarbeitung dieser Batterie lohnt sich oft sehr. Deshalb nimmt der Handel diese Batterien wieder zurück. Hier kann eine Spannung von ungefähr 1,5 Volt erreicht werden.
4.5 Lithium ist eines der unedelsten Metalle, das wir kennen. Es eignet sich daher sehr gut als Elektrodenmaterial für die Kathode einer Batterie. Als Anodenmaterial kann man verschiedene Stoffe verwenden. Nutzbar ist z.B. Chromoxid, Bismutoxid, Braunstein oder Thionylchlorid. Je nach Material entstehen dann unterschiedliche Spannungen. Am Beispiel des Braunsteins soll das Prinzip hier erklärt werden. Dabei wird am Minuspol Lithium oxidiert und am Pluspol Mangandioxid reduziert. Als Elektrolyt dient hier Lithiumperchlorat mit wasserabschirmenden organischen Lösungsmitteln, da das Lithium sehr heftig mit Wasser reagiert. Das ist eine kennzeichnende Eigenschaft für die Elemente der ersten Hauptgruppe, der Alkalimetalle. Das Lithium wird bei der Reduktion ins Mangandioxid einge-
lagert. Durch eine weitere Reaktion mit dem Elektrolyten wird der Stromkreis wieder geschlossen.
Li à Li+ + e- (Oxidation)
Li+
+ e- + MnO2 à LiMnO2 (Reduktion)
Li + MnO2
à LiMnO2 (Redoxreaktion)
Eine große Verwendungsmöglichkeit findet dieser Batterietyp in Herzschrittmachern, Uhren, u.a..
Diese Batterie kann eine Spannung von bis zu 2,9 Volt liefern.
4.6 Wenn man nun diese Batterietypen vergleicht, wird man Vor- und Nachteile feststellen. Folgende Tabelle soll darüber Aufschluss geben.
Abb.8
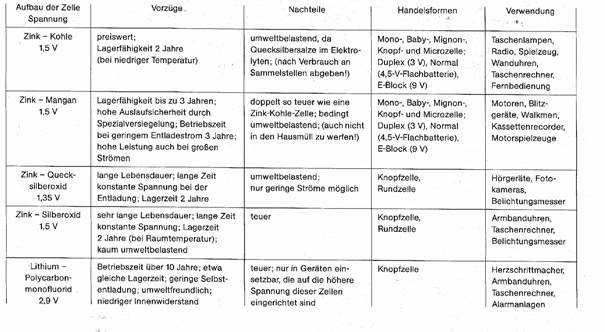
5.
5.1 Normale Batterien, die auch Primärelemente genannt werden, haben einen Nachteil; die in ihr stattge-
fundene Reaktion ist nicht wieder umkehrbar. Man musste eine Möglichkeit finden die Reaktionen wieder umzukehren. Die sogenannten Akkumulatoren (lat. accumulare: anhäufen), oder auch Sekundärelemente genannt, wurden eingeführt.
Die für die Stromerzeugung genutzten Reaktionen können hier wieder rückgängig gemacht werden. Die elektrische Energie wird hier gespeichert und in Form von chemischer Energie, die bei der Entladung wieder in elektrische Energie umgewandelt wird, abgegeben.
5.2 In der Praxis wird am häufigsten der Bleiakkumulator verwendet. Er besteht aus zwei Bleiplatten, die in 20%ige Schwefelsäure tauchen. Dabei überziehen sie sich mit einer dünnen Schicht Bleisulfat. Werden nun beide Platten mit einer Gleichstromquelle verbunden, wandern Elektronen zur Kathode. Hierbei nehmen die vorhandenen Bleiionen Elektronen auf und es scheidet sich elementares Blei ab:
Reaktionsgleichung: Pb2+ + 2e- à
Pb(Reduktion).
An der Anode wird jedoch aus dem Bleisulfat eine braune Schicht Blei(IV)- oxid. Eine Farbänderung ist also zu beobachten. Die Bleiionen reagieren mit Wasser zu Bleioxid, Hydroniumionen und Elektronen:
Reaktionsgleichung: Pb2+ + 6H2O
à
PbO2 + 4H3O+ + 2e- (Oxidation).
Die so entstandene chemische Energie wird gespeichert und dann beim Entladen in Form von elektrischer Energie wieder abgegeben. Beim Entladen des Akkumulators finden die Reaktionen genau umgekehrt statt. Hierbei findet- genauer betrachtet- eine Redoxreaktion statt. Hierbei entstehen an der Kathode sowie an der Anode Pb2+ - Ionen:
Reaktionsgleichung: Pb à
Pb2+ + 2e- (Oxidation)
Reaktionsgleichung: PbO2 + 4H3O+
+ 2e- à
Pb2+ + 6H2O (Reduktion).
Im geladenen Zustand ist der Bleiakkumulator ein galvanisches Element. Wenn sich allerdings zwei Elektroden gegenüber stehen ist diese Bezeichnung nicht mehr verwendbar. Die elektrische Spannung beträgt hier etwa 2 Volt. Durch Hintereinanderschalten von sechs derartigen „Zellen“ , erhält man eine Spannung (12 Volt), die etwa mit der einer Autobatterie vergleichbar wäre. Der Gesamtvorgang im Akku-
mulator sieht wie folgt aus:
|
|
Die Reaktionen beim Aufladen: Entladen:
Abb.9 Abb.10
Abb.10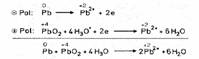
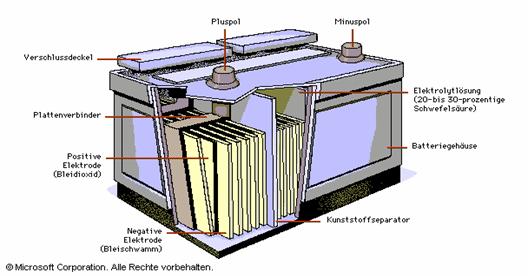
Aufbau eines Bleiakkumulators, wie er auch als
wieder aufladbare Autobatterie verwendet wird:
Abb.11
erster Bleiakkumulator nach Gaston Planté 1859:
Abb.12

Sich hier mit der Frage auseinander zu setzen, warum ein Akkumulator im allgemeinen nicht unendlich oft aufgeladen werden kann, halte ich für sinnvoll. Beim Aufladen dieses Akkus entsteht nämlich elementares Blei und da Blei schwerer als der Elektrolyt ist, bleibt das Blei nicht unbedingt an der Elektrode, sondern fällt nach unten. Wenn sich das Blei nun nicht an der Elektrode befindet, sondern in der Lösung schwimmt, kann es nicht an den entscheidenden Reaktionen teilnehmen und irgendwann ist die Reaktion überhaupt nicht mehr möglich, da kein Blei mehr da ist. Das wäre eine mögliche Erklärung für dieses Problem.
5.3 Im geladenen Zustand bestehen die Elektroden dieses Akkumulators am Minuspol aus Cadmium und am Pluspol aus Nickel(III)- oxidhydroxid. Als Elektrolytlösung verwendet man 20%ige Kalilauge. Beim Entladen laufen hierbei nun folgende Reaktionen ab:
Cd + 2OH- à
Cd(OH)2 + 2e- (Oxidation/ Minuspol)
2NiOOH + 2H2O + 2e- à Ni(OH)2 + 2OH-
(Reduktion/ Pluspol).
Die Kalilauge liefert hierbei die Hydroxidionen und das Wasser. Beim Aufladen wird dem Akku elektrische Energie zugeführt und wiederum in chemische Energie umgewandelt. Zusammengefasst sieht die Gesamtreaktion wie folgt aus:
Entladen
![]()
![]() Cd + 2NiOOH + 2H2O Cd(OH)2 +
Ni(OH)2 .
Cd + 2NiOOH + 2H2O Cd(OH)2 +
Ni(OH)2 .
Laden
Beim näheren Betrachten des Vorganges fällt auf, dass kein wesentlicher Unterschied zum Bleiakkumulator besteht. Dieser Akkumulator liefert eine Spannung von maximal 1,3Volt. Diese Akkumulatoren verwendet man vorwiegend für elektrische Geräte, wie z.B. Taschenlampen, Walkmans, u.a.. Sie müssen jedoch umweltfreundlich entsorgt werden, da ihr Schwermetallgehalt sehr hoch ist. Außerdem sind gerade Nickel und Cadmium sehr giftig und sind deshalb mit „Vorsicht zu genießen“.
Bei diesem Akkumulator kann eine Besonderheit
auftreten, die dem Benutzer schnell zum Nachteil werden kann- der Memory-
Effekt. Der Memory-Effekt ist ein
Problem, das einen Ni-Cd-Akku bei falscher Benutzung schnell lahm legen kann.
Hier die technische Erklärung: Wenn Sie einen Ni-Cd-Akku mit niedrigen Strömen
dauerladen oder vor der vollständigen Entleerung aufladen, d.h. nur
Teilladungen durchführen, entstehen auf der negativen Elektrode bestimmte
chemische Phasen (Verbindungen), die sich durch mehrmalige Wiederholung dieser
Vorgänge noch weiter verstärken. Dadurch verringert sich die verfügbare Energie
immer mehr, indem der Akku nur noch wenige Minuten die nötige Spannung liefert.
Abb.13
|
|
|
|
|
|
|
Entladen Laden Entladen Laden
|
5.4 Eine bessere Erfindung in diesem Bereich stellt der Nickel/ Metallhydrid (Ni/MH)- Akkumulator dar. Er ist umweltfreundlicher, weniger giftig und erbringt eine fast gleichhohe Spannung, wie der Nickel/ Cadmium- Akku. Chemisch ist es hier wichtig, Wasserstoff speichernde, Metallhydrid bildende Metalle zu verwenden. Man benutzt als Wasserstoffspeicher spezielle Legierungen, z.B. Mm*Ni3,5Co0,7Mn0,4Al0,3 oder V15Ti15Zr20Ni28Cr5Co5Fe6Mn6 . Für diese Legierungen ist es wichtig, dass sie eine hohe Aufnahme-
kapazität für Wasserstoff haben. Am Minuspol befindet sich also das Metallhydrid und am Pluspol erneut Nickel(III)- oxidhydroxid. Als Elektrolyt dient wieder Kaliumhydroxid- Lösung. Es laufen folgende Reaktionen ab:
Metall-H2 + 2OH- à
Metall + 2H2O + 2e- (Oxidation/ Minuspol)
2NiOOH + 2H2O + 2e- à 2 Ni(OH)2 + 2OH-
(Reduktion/ Pluspol).
Durch Anlegen einer ausreichend großen Spannung können die entsprechenden Umkehrreaktionen erreicht werden. Die Gesamtreaktion sieht wie folgt aus:
Entladen
![]()
![]() Metall-H2 + 2NiOOH Metall + 2 Ni(OH)2.
Metall-H2 + 2NiOOH Metall + 2 Ni(OH)2.
Laden
Dieser Akku kann eine maximale Spannung von 1,2 Volt erreichen. Vorwiegend als Knopf- und Rundzellen kommen diese Batterien auf den Markt. Der Memory- Effekt findet hier nur sehr schwach statt. Interessant wäre nun noch der Vergleich dieser drei Akkus.
|
Abb.14 |
Blei- Akku |
Ni/
Cd- Akku |
Ni/
MH- Akku |
|
Preis |
sehr gut |
gut |
weniger gut |
|
Ladezeit |
weniger gut |
sehr gut |
gut |
|
Zuverlässigkeit |
sehr gut |
gut |
gut |
|
Umweltver- träglichkeit |
weniger gut |
schlecht |
sehr gut |
*Mm = Lanthanreiches
Mischmetall mit 50% Lanthan, 30% Cer und 14% Neodym
6. Die Historie der Batterie
reicht sehr weit zurück. Bereits im 17. Jahrhundert fing man Versuche zur
Herstellung von Elektrizität an. Der erste nennenswerte Mensch, der hier
Beachtliches leistete, war Luigi Galvani. Unbewusst konstruierte Galvani die
erste Form der Batterie. Er entdeckte mit seinem Frosch-
schenkelversuch im Jahre 1786, dass Froschschenkel bei Zuführung von Elektrizität zucken. Er forschte weiter und nahm zwei verschiedene Metallstäbe, die er mit dem Frosch in Berührung brachte- wiederum zuckte er. Galvani fand jedoch keine Erklärung für seine Ergebnisse. Eine Erklärung fand aber Alessandro Volta. Er untersuchte denselben Versuch, jedoch immer für unterschiedliche Metalle und fand heraus, dass manche Metalle unterschiedlich stark die Elektrizität hervorrufen. Er legte damit die Basis für die elektrochemische Spannungsreihe der Metalle. Weiterhin baute er die VOLTAsche Säule, die die Stoffumwandlungen bei solchen Versuchen belegt. 1807 führte der Physiker Davy Versuche mit der VOLTAschen Säule durch. Die nun eigentliche Erfindung der Batterie wird dem Chemiker Berzelius zugeschrieben, der mit den Vorarbeiten von Volta und Galvani wohl bewusst die erste Batterie entdeckte. Die Basis für den ersten Akkumulator legte der Physiker Johann Wilhelm Ritter, der mit der VOLTAschen Säule Elektrizität erzeugte, obwohl die Reaktion schon stattgefunden hatte.
Abb.15
Abb.16
Quellennachweise:
a)
Textnachweise:
-
Wissensspeicher Chemie, Klaus Sommer, 1985, Berlin
-
CVK Chemie für die Sekundarstufe 1,
Geiger/ Haupt/ Kloppert/ Kunze, 1994, Berlin
-
Chemie heute Sekundarbereich 2, Asselborn/ Jäckel/ Risch, 2000,
Hannover
-
Schülerduden Chemie, Borucki/ Fischer/ Rességuier/ Reuß/ Standemann,
Zürich, 1995
-
Internet: www.ict.fhg.de
members.tripod.de/stuhl1/-el2.html
b)
Abbildungsnachweise:
-
Chemie heute Sekundarbereich 2, Asselborn/ Jäckel/ Risch, 2000,
Hannover: Abb.2,7
-
CVK Chemie für die Sekundarstufe 1,
Geiger/ Haupt/ Kloppert/ Kunze, 1994, Berlin: Abb.8,15,16
-
Schülerduden Chemie, Borucki/ Fischer/ Rességuier/ Reuß/ Standemann, Zürich,
1995: Abb.1,3,4,9,10
-
www.varta.com:
Abb.5,6,13
-
Microsoft Encarta 99 CD-Rom:
Abb.11,12